
G-BA schreckt Biosimilar-Hersteller in Deutschland auf
Große Aufregung im Biosimilar-Sektor. Der Gemeinsame Bundesausschuss (G-BA) hat nun die lange umkämpfte Regelung der automatischen Substitution beschlossen. Demnach sind Apotheker verpflichtet, das kostengünstigste Medikament als Ersatz für das Originalpräparat zu verwenden. Eine standortbezogene, industriepolitische Entscheidung über eine Art "Europe first"-Strategie sei damit ausgeschlossen, dem preislich kostengünstiger anbietenden Asien wären alle Tore geöffnet.
Ab April kommenden Jahres sollen Apotheken ärztlich verordnete Biologika durch preisgünstigere Biosimilars ersetzen können. Der Gemeinsame Bundesausschuss (G-BA) hat jetzt die dafür notwendigen Kriterien beschlossen. Der neue Regelungstext wurde im § 40c der Arzneimittelrichtlinie verankert und liegt nun dem Bundesministerium für Gesundheit zur Prüfung vor. Wird er nicht beanstandet, könnte er nach Veröffentlichung im Bundesanzeiger frühestens im April 2026 in Kraft treten – ein Schritt, der aus Sicht vieler Branchenvertreter zwar Einsparungen verspricht, zugleich aber erhebliche industriepolitische Risiken birgt.
Die Möglichkeit, teure Original-Präparate im Rahmen der Aut-idem-Regelung auszutauschen, gilt bei chemisch-synthetischen Arzneimitteln seit langem. Bei Biologika war sie bislang auf individuell zubereitete Infusions- und Injektionslösungen beschränkt. Nun soll der Austausch breiter möglich werden. Ziel sei es, Kosten für die gesetzliche Krankenversicherung zu reduzieren, betonte G-BA-Chef Josef Hecken.
Damit Apotheken ein Biologikum ersetzen dürfen, müssen unter anderem Anwendungsgebiet, Applikationsart, Wirkstärke, Packungsgröße und Darreichungsform identisch sein. Grundsätzlich sollen sowohl Referenzarzneien durch ihre Biosimilars als auch Biosimilars untereinander austauschbar sein – sofern sie sich auf dasselbe Referenzprodukt beziehen. Ärztliche oder patientenindividuelle Ausschlussgründe können den Austausch verhindern.
Droht eine Verlagerung nach Asien wie bei Generika?
Doch genau dieser konsequente Preisfokus ruft erhebliche Kritik hervor. Branchenvertreter warnen massiv, dass die neuen Vorgaben den Wettbewerb so stark und ausschließlich über den Preis bestimmen würden, dass europäische Hersteller kaum mithalten könnten, während asiatische Produzenten, insbesondere aus China oder Südkorea, ihre Marktposition ausbauen dürften.
Die im Industrieverband Pro Generika zuständige AG Pro Biosimilars sieht darin die Wiederholung eines bekannten Musters: „Der Beschluss riskiert die Versorgungssicherheit mit biopharmazeutischen Arzneimitteln in Deutschland. Dieser übermäßige Kostendruck hat schon im Generikamarkt zur Verlagerung der Produktion und zu einer starken Abhängigkeit von China geführt“, sagte Walter Röhrer, Vorsitzender der AG. Nun drohe dasselbe im sensibleren Biopharma-Bereich.
Aus Sicht des Verbands kommt die Entscheidung „zur Unzeit“. China investiere massiv, um im Biopharma-Sektor Weltmarktführer zu werden. Gleichzeitig würden deutsche und europäische Biosimilar-Hersteller durch exklusive Rabattverträge weiter unter Druck gesetzt. Diese Ausschreibungen müssten abgeschafft werden, fordert Pro Generika, sonst drohe der industrielle Rückzug aus Europa. Dorothee Brakmann vom Verband Pharma Deutschland mahnt, dass kurzfristige Kostensenkungen zu kurz gedacht seien. Sie warnt in apotheke adhoc, der G-BA-Beschluss wiederhole Fehler aus dem Generikamarkt: Einseitiger Kostendruck habe dort zu Lieferengpässen und Produktionsabwanderung geführt. Exklusive Rabattausschreibungen gefährdeten Vielfalt und Resilienz. Die Neuregelung dürfe die Versorgungssicherheit nicht schwächen und sollte unter dem Resilienzgedanken und langfristiger Kostenstabilität betrachtet werden. Sie fordert das BMG auf, den Beschluss strategisch zu prüfen.
Investitionen mit Fragezeichen?
Ein Biosimilar-Pionier ist die schweizerisch-deutsche Sandoz Gruppe mit ihrem großen Forschungs-, Entwicklungs- und Produktionszentrum in Kundl bei Kufstein, der ehemaligen Biochemie AG. Für den Generikahersteller, ehemals ein Teil von Novartis, sind die Biosimilars zum strategischen Eckpfeiler geworden. So entwickelt sich auch das Biosimilar-Geschäft besonders rasant, das in den vergangenen 9 Monaten erstmals über 30% des Gesamtumsatzes ausmachte. Hier erzielte Sandoz ein Wachstum von 12%, während Generika nur um 2% zulegten und kaum mehr Wachstum versprechen.
Auch für ein Unternehmen der „Nachahmerprodukte“ unter besonders starkem Kostendruck kann dabei noch eine EBITDA-Marge von rund 20% herausspringen. CEO Richard Saynor betonte anlässlich der 9-Monats-Zahlen die starke Pipeline und die wachsende Bedeutung von Biosimilars für den Zugang zu erschwinglichen Arzneien. Dreistellige Millionen hat das Unternehmen für den Produktionsausbau in Slowenien investiert, wo ein neuer Pfeiler der bisher im österreichischen Kundl und in Holzkirchen bei München beheimateten Forschung, Entwicklung und Herstellung entsteht.
Gegenüber |transkript.de betont eine Unternehmenssprecherin von Sandoz daher erneut diesen Zusammenhang zur Versorgungssicherheit: „Eine resiliente Versorgung mit hochwertigen und bezahlbaren biopharmazeutischen Arzneimitteln ist für Deutschland und Europa unverzichtbar. Die aktuelle Entscheidung setzt dieses Ziel unter Druck. Es braucht jetzt klare politische Weichenstellungen, um die Widerstandsfähigkeit des Systems und die Versorgungssicherheit für Patientinnen und Patienten langfristig zu gewährleisten.“

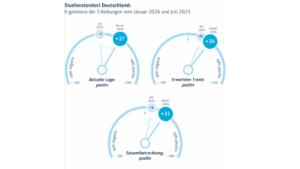 BVMA, vfa, BPI
BVMA, vfa, BPI Pete Linforth bei Pixabay
Pete Linforth bei Pixabay Optimed Medizinische Instrumente GmbH
Optimed Medizinische Instrumente GmbH